
Gibson Assembly┬«’╝łÕÉēÕĖāµŻ«ń╗äĶŻģ’╝ēµł¢ń¦░ÕÉēÕĖāµŻ«ÕģŗķÜå’╝īµś»õĖĆń¦ŹÕ╝║Õż¦ńÜäÕłåÕŁÉÕģŗķÜåµŖƵ£»’╝īµś»õ╝Āń╗¤ķÖÉÕłČµĆ¦ÕåģÕłćķģȵ¢╣µ│ĢńÜäõĖĆń¦ŹµĄüĶĪīµø┐õ╗Żµ¢╣µĪłŃĆé
ķĆÜĶ┐ćÕŹĢń«ĪµüƵĖ®ÕÅŹÕ║ö’╝īGibson AssemblyĶāĮÕż¤µŚĀń╝ØĶ┐׵ğDNAńē浫ĄŃĆéÕ«āńē╣Õł½ķĆéńö©õ║Äõ╗ÄÕżÜõĖ¬ńē浫Ąµ×äÕ╗║Õż¦Õ×ŗµł¢ÕżŹµØéńÜäń╗ōµ×ä’╝īÕ╣ČõĖöÕÅ»ĶāĮµ»öÕģČõ╗¢ÕģŗķÜåµ¢╣µ│Ģµø┤Õ┐½ŃĆé
µŚĀĶ«║µé©µś»õĖĆõĮŹń╗Åķ¬īõĖ░Õ»īńÜäńĀöń®Čõ║║Õæś’╝īĶ┐śµś»ÕłÜµÄźĶ¦”Gibson AssemblyÕ«×ķ¬īµ¢╣µĪłńÜäµ¢░µēŗ’╝īµ£¼µīćÕŹŚķāĮµ▒ćķøåõ║åµłæõ╗¼ÕłåÕŁÉńö¤ńē®ÕŁ”ķóåÕ¤¤õĖōÕ«ČńĀöÕÅæń¦æÕŁ”Õ«ČńÜäń╗Åķ¬īõĖÄÕ┐āÕŠŚŃĆé
ńø«ÕĮĢ
õ╗Ćõ╣łµś»Gibsonń╗äĶŻģ’╝¤
Gibsonń╗äĶŻģµś»õĖĆń¦ŹÕ╝║Õż¦ńÜäDNAń╗äĶŻģµ¢╣µ│Ģ’╝īõŠØĶĄ¢õ║ÄõĖēń¦ŹķģČ’╝ÜÕż¢ÕłćķģČŃĆüDNAĶüÜÕÉłķģČÕÆīDNAĶ┐׵ğķģČŃĆé
Ķ»źĶ┐ćń©ŗÕīģµŗ¼ÕøøõĖ¬õĖ╗Ķ”üķśČµ«Ą’╝Ü
- Õż¢ÕłćķģČÕżäńÉå’╝ÜĶ»źķģČõ╗ÄDNAńē浫ĄńÜä5ŌĆ▓ń½»Õ╝ĆÕ¦ŗÕłćÕē▓’╝īÕĮóµłÉÕŹĢķōŠń¬üÕć║µ£½ń½»ŃĆé
- ķĆĆńü½’╝ÜDNAńē浫ĄńÜäõ║ÆĶĪźÕī║Õ¤¤ńøĖõ║ÆķĆĆńü½ń╗ōÕÉłŃĆé
- DNAĶüÜÕÉłķģČÕ╗Čõ╝Ė’╝ÜDNAĶüÜÕÉłķģČÕĪ½ĶĪźń╝║ÕÅŻŃĆé
- Ķ┐׵ğDNAĶ┐׵ğķģČÕÅ»Õ░üķŚŁDNAõĖ╗ķōŠõĖŁńÜäÕłćÕÅŻ’╝īõ╗ÄĶĆīÕĮóµłÉĶ┐×ń╗ŁńÜäDNAÕłåÕŁÉŃĆé
õĮĀÕÅ»õ╗źÕ░åµ»ÅõĖ¬DNAńē浫Ąµā│Ķ▒ĪµłÉõĖĆÕØŚÕóÖń║Ėµł¢ńż╝ÕōüÕīģĶŻģń║ĖńÜäńóÄńēć’╝øĶŗźµā│Õ░åõĖżÕØŚńóÄńēćĶ┐×µÄźÕ£©õĖĆĶĄĘĶĆīń£ŗõĖŹÕł░µÄźń╝Ø’╝īÕÅ»õ╗źÕ»╗µēŠõĖżõĖ¬ńóÄńēćÕē¬ÕłćĶŠ╣ń╝śÕżäÕøŠµĪłÕ«īÕģ©ķćŹÕÅĀńÜäÕī║Õ¤¤’╝īńäČÕÉÄÕ░åÕ«āõ╗¼ń▓śÕÉłÕ£©õĖĆĶĄĘŃĆé
Õ£©Ķ┐ÖõĖ¬ń▒╗µ»öõĖŁ’╝īµ»ÅõĖ¬DNAńē浫Ąµ£½ń½»ńÜäÕŹĢķōŠń¬üÕć║ķā©ÕłåÕ░▒ÕāÅÕøŠµĪłńÜäĶŠ╣ń╝śŌĆöŌĆöńö▒Õż¢ÕłćķģČÕłćÕē▓ÕĮóµłÉ’╝īĶĆīķĆĆńü½Ķ┐ćń©ŗÕłÖń▒╗õ╝╝õ║ÄÕ»╗µēŠĶ¦åĶ¦ēõĖŖÕøŠµĪłķćŹÕÅĀńÜäĶ┐ćń©ŗŃĆéĶüÜÕÉłķģČÕÆīĶ┐׵ğÕÅŹÕ║öÕ░åńē浫ĄÕø║Õ«ÜÕ£©õĖĆĶĄĘ’╝īõĖŹõ╝ÜńĢÖõĖŗõ╗╗õĮĢÕÅ»Ķ¦üńÜäńŚĢĶ┐╣µł¢ń¢żńŚĢŃĆé
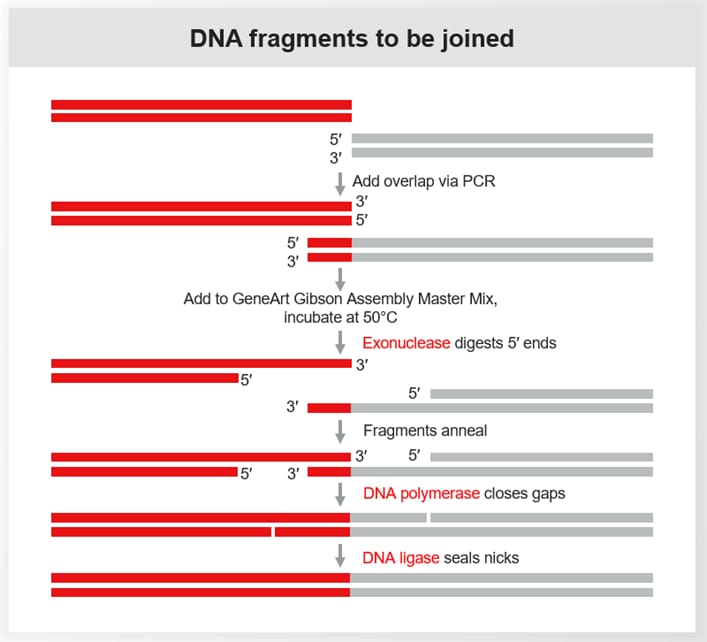
õĮĢµŚČõ╗źÕÅŖõĖ║õĮĢõĮ┐ńö©Gibson AssemblyĶ┐øĶĪīÕłåÕŁÉÕģŗķÜå
ÕÉēÕĖāµŻ«’╝łGibson’╝ēń╗äĶŻģµŖƵ£»ńøĖµ»öõ╝Āń╗¤ńÜäķÖÉÕłČµĆ¦ÕåģÕłćķģČÕģŗķÜåµ¢╣µ│ĢÕģʵ£ēõĖĆõ║øõ╝śÕŖ┐’╝īÕīģµŗ¼’╝Ü
- ĶāĮÕż¤ÕÉīµŚČĶ┐×µÄźÕżÜõĖ¬DNAńē浫Ą’╝łµ£ĆÕżÜÕÅ»ĶŠŠ6õĖ¬’╝ē’╝īµŚĀĶ«║ÕģČÕ║ÅÕłŚÕ”éõĮĢ’╝īõĖöµŚĀķ£Ćńē╣Õ«ÜńÜäķÖÉÕłČµĆ¦ķģČÕłćõĮŹńé╣
- ńē浫Ąõ╣ŗķŚ┤ÕÅ»õ╗źÕ«×ńÄ░ń▓ŠńĪ«õĖöµŚĀń╝ØńÜäĶ┐׵ğ’╝īõĖŹõ╝Üõ║¦ńö¤ń¢żńŚĢ
- ńøĖµ»öķÖÉÕłČµĆ¦ķģČÕłćÕģŗķÜåµ¢╣µ│Ģ’╝īµŁźķ¬żµø┤Õ░æŃĆüĶĆŚµŚČµø┤ń¤ŁŌĆöŌĆöķĆÜÕĖĖÕ£©õĖĆÕ░ŵŚČõ╣ŗÕåģÕŹ│ÕŻիīµłÉ
ÕÉēÕĖāµŻ«ÕģŗķÜåµŖƵ£»Õģʵ£ēĶ«ĖÕżÜÕ«×ķÖģÕ║öńö©’╝īÕÅ»ńö©õ║ĵŚĀń╝ØĶ┤©ń▓Ƶ×äÕ╗║ŃĆüÕÉłµłÉÕ¤║ÕøĀÕÆīÕ¤║ÕøĀń╗äń╗äĶŻģŃĆüCRISPRĶĮĮõĮōµ×äÕ╗║ŃĆüÕ«Üńé╣ń¬üÕÅśŃĆüµ©ĪÕØŚÕī¢DNAÕģāõ╗Čń╗äĶŻģ’╝īõ╗źÕÅŖńö©õ║ÄÕ¤║ÕøĀµ▓╗ń¢ŚÕÆīńĀöń®ČńÜäńŚģµ»ÆĶĮĮõĮōÕ╝ĆÕÅæŃĆé

Gibson AssemblyÕ«×ķ¬īµ¢╣µĪł
Ķ»ź Gibson ń╗äĶŻģÕģŗķÜåµ¢╣µ│Ģµś»õĖĆń¦ŹÕŹĢµŁźńŁēµĖ®Ķ┐ćń©ŗ’╝īķĆÜÕĖĖµēĆķ£ĆńÜäÕŖ©µēŗµōŹõĮ£µŚČķŚ┤õĖŹÕł░õĖĆÕ░ŵŚČ’╝īÕģĘõĮōµŚČķŚ┤ÕÅ¢Õå│õ║ĵēƵČēÕÅŖńÜäDNAńē浫ĄµĢ░ķćÅŃĆé
Ķ»źÕ«×ķ¬īµ¢╣µĪłµ£ēÕøøõĖ¬Õģ│ķö«µŁźķ¬żŃĆé
1. ĶÄĘÕÅ¢DNAńē浫Ą
Gibsonń╗äĶŻģńÜ䵳ÉÕŖ¤õĖÄÕɔգ©ÕŠłÕż¦ń©ŗÕ║”õĖŖÕÅ¢Õå│õ║ÄDNAńē浫ĄÕÅŖÕģČķćŹÕÅĀÕī║Õ¤¤ńÜäĶ«ŠĶ«ĪŃĆé
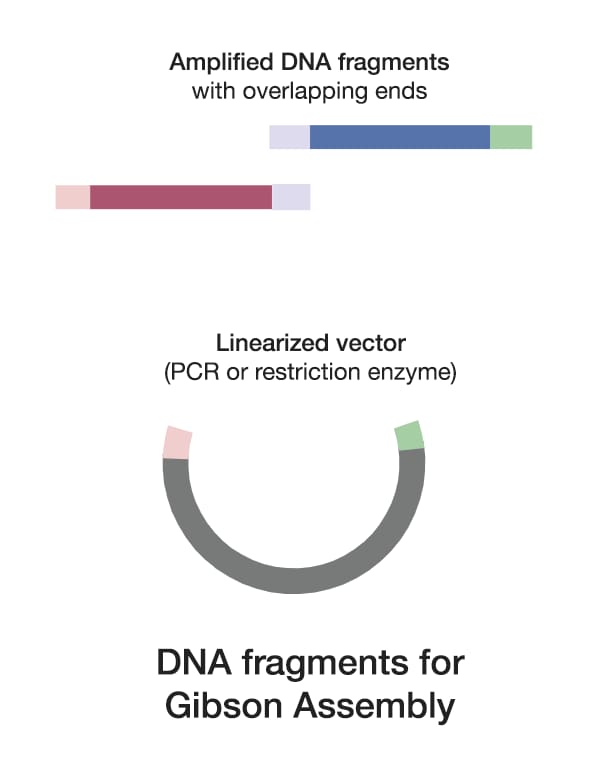
Ķ»Ęõ╗öń╗åĶ«ŠĶ«ĪķćŹÕÅĀÕ║ÅÕłŚŃĆé
ķćŹÕÅĀÕī║Õ¤¤ķĢ┐Õ║”Õ║öµÄ¦ÕłČÕ£©20-40õĖ¬ńó▒Õ¤║Õ»╣’╝īÕ╣ČńĪ«õ┐ØÕģČÕģʵ£ēĶŠāķ½śńÜäGCÕɽķćÅõ╗źõ┐āĶ┐øń©│Õ«ÜńÜäķĆĆńü½ń╗ōÕÉłŃĆé ÕÅ»õ╗źõĮ┐ńö©Õ”éõĖŗĶĮ»õ╗ČÕĘźÕģĘ’╝Ü┬ĀSnapGeneŌäó┬ĀÕÅ»ńö©õ║Äń▓ŠńĪ«Ķ«ŠĶ«ĪĶ┐Öõ║øķćŹÕÅĀÕī║Õ¤¤ŃĆé
õ╝śÕī¢PCRµØĪõ╗Č
õĖ║õ║åńĪ«õ┐Øķ½śĶ┤©ķćÅńÜäPCRõ║¦ńē®’╝īĶ»ĘķÆłÕ»╣µ»ÅõĖ¬DNAńē浫Ąõ╝śÕī¢PCRµØĪõ╗ČŃĆéõĮ┐ńö©ķ½śõ┐Øń£¤DNAĶüÜÕÉłķģČ’╝īõŠŗÕ”éPlatinumŌäó SuperFi II PCRķóäµĘʵČ▓’╝īõ╗źÕćÅÕ░æķöÖĶ»»Õ╣ČńĪ«õ┐Øõ║¦ńö¤Õ╣▓ÕćĆŃĆüńē╣Õ╝éńÜäńē浫ĄŃĆéń║»Õī¢PCRõ║¦ńē®õ╗źĶÄĘÕŠŚÕ╣▓ÕćĆńÜäDNAńē浫Ą’╝īÕ╣ČÕ£©Ķ┐øĶĪīõĖŗõĖƵŁźõ╣ŗÕēŹķĆÜĶ┐ćÕćØĶāČńöĄµ││ķ¬īĶ»üPCRõ║¦ńē®ńÜäÕ«īµĢ┤µĆ¦
ń║┐µĆ¦Õī¢µēĆķĆēĶĮĮõĮō
ķĆēµŗ®ķĆéÕÉłµé©ń╗äĶŻģķ£Ćµ▒éńÜäĶĮĮõĮō’╝īÕ╣ČķĆÜĶ┐ćķÖÉÕłČµĆ¦ÕåģÕłćķģȵł¢PCRÕ░åÕģČń║┐µĆ¦Õī¢ŃĆéń║┐µĆ¦Õī¢Ķć│Õģ│ķćŹĶ”ü’╝īÕøĀõĖ║Õ«āõĖ║ńē浫ĄńÜäķĆĆńü½ÕÆīĶ┐׵ğµÅÉõŠøõ║åÕ┐ģĶ”üńÜäµ£½ń½»ŃĆéÕĮōõĮ┐ńö©ńÄ»ńŖČĶ┤©ń▓ÆDNAõĮ£õĖ║µ©ĪµØ┐µŚČ’╝īĶ»ĘõĮ┐ńö© DpnI õ╗źÕćÅÕ░æĶĮ¼Õī¢ÕÉÄńÜ䵩ĪµØ┐ĶāīµÖ»ŃĆé
2. µē¦ĶĪīGibsonÕÅŹÕ║ö
Ķ”üÕ«×ńÄ░µłÉÕŖ¤ńÜäGibsonń╗äĶŻģ’╝īÕ┐ģķĪ╗õ╗öń╗åõ╝śÕī¢ÕÅŹÕ║öµØĪõ╗ČŃĆéÕÅ»õ╗źõĮ┐ńö©Ķ»ĖÕ”é┬ĀGeneArtŌäó Gibson AssemblyŌäó HiFi Master Mix.
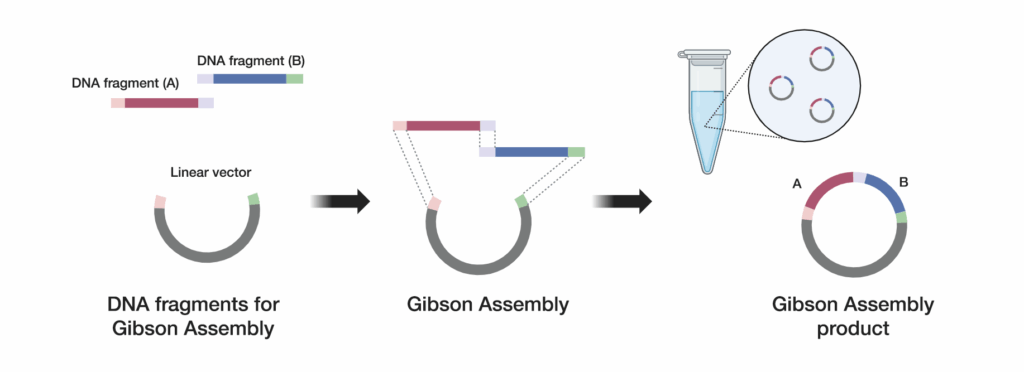
Ķ»ĘÕ░ÅÕ┐āÕ£░Õ░åµé©Ķ«ŠĶ«ĪńÜäDNAńē浫ĄÕÆīń║┐µĆ¦Õī¢ĶĮĮõĮōµĘĘÕÉł
ńĪ«õ┐ØÕćåńĪ«Ķ«Īń«ŚÕ╣ȵŁŻńĪ«ÕłåķģŹÕŹĢń«ĪÕÅŹÕ║öõĖŁµ»Åń¦Źń╗äÕłåńÜäńö©ķćÅŃĆéÕģ│µ│©Ķ┐Öõ║øń╗åĶŖéµ£ēÕŖ®õ║ÄÕ«×ńÄ░ķ½śµĢłńÜäDNAńē浫Ąń╗äĶŻģŃĆé
ÕīģÕɽջ╣ńģ¦ÕÅŹÕ║ö
Õ£©Õ«×ķ¬īõĖŁÕ¦ŗń╗łÕīģÕɽķś│µĆ¦ÕÆīķś┤µĆ¦Õ»╣ńģ¦ŃĆéķś│µĆ¦Õ»╣ńģ¦ÕÅ»ńĪ«Ķ«żń╗äĶŻģÕÅŹÕ║öµØĪõ╗ČńÜäµ£ēµĢłµĆ¦’╝īĶĆīķś┤µĆ¦Õ»╣ńģ¦’╝łń╝║Õ░æõĖĆõĖ¬µł¢ÕżÜõĖ¬DNAńē浫Ą’╝ēµ£ēÕŖ®õ║ÄĶ»åÕł½µĮ£Õ£©µ▒Īµ¤ōµł¢ķØ×ńē╣Õ╝éµĆ¦ń╗äĶŻģŃĆé
3. ĶĮ¼Õī¢µä¤ÕÅŚµĆüń╗åĶā×
õĮ┐ńö©ķ½śµĢłµä¤ÕÅŚµĆüń╗åĶā×’╝īõŠŗÕ”é┬ĀOne ShotŌäó TOP10 Chemically Competent E. coli, õ╗źµ£ĆÕż¦Õī¢ĶÄĘÕŠŚµłÉÕŖ¤ńÜäĶĮ¼Õī¢ÕŁÉµĢ░ķćÅŃĆéķĆéÕĮōńÜäÕŁĄĶé▓µŚČķŚ┤ÕÆīµĖ®Õ║”Õ»╣õ║ÄĶÄĘÕŠŚµ£ĆõĮ│ń╗ōµ×£Ķć│Õģ│ķćŹĶ”üŃĆé
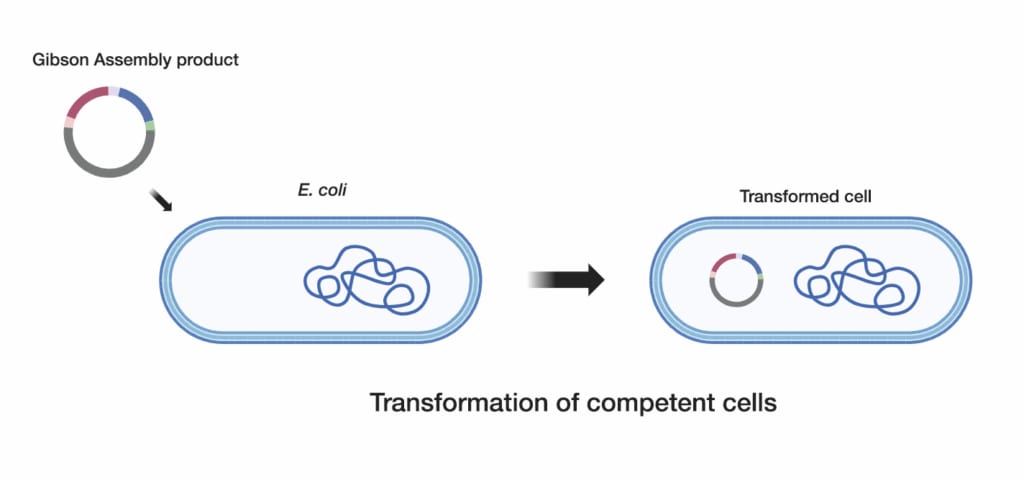
Õ░åĶĮ¼Õī¢µĘĘÕÉłńē®µČéÕĖāÕ£©ÕÉłķĆéńÜäÕ╣│µØ┐õĖŖ
Õ░åĶĮ¼Õī¢ÕÉÄńÜäń╗åĶā×µČéÕĖāÕ£©ķĆēµŗ®µĆ¦LBńÉ╝ĶäéÕ╣│µØ┐õĖŖ’╝īõ╗źÕłåń”╗ÕŹĢõĖ¬ĶÅīĶÉĮŃĆ鵣żµŁźķ¬żÕ»╣õ║ÄńĪ«õ┐ØÕŬµ£ēÕɽµ£ēµŁŻńĪ«ń╗äĶŻģDNAµ×äÕ╗║õĮōńÜäń╗åĶā×µēŹĶāĮńö¤ķĢ┐Ķć│Õģ│ķćŹĶ”üŃĆé
4. ńŁøķĆēµ×äÕ╗║õĮōńÜäĶÅīĶÉĮ
ńŁøķĆēÕżÜõĖ¬ĶÅīĶÉĮõ╗źķ¬īĶ»üµé©ńÜäDNAµ×äÕ╗║õĮōµś»ÕÉ”µŁŻńĪ«ń╗äĶŻģŃĆéõĮ┐ńö©ĶÅīĶÉĮPCRŃĆüķÖÉÕłČµĆ¦ķģČÕłćµł¢µĄŗÕ║ŵ¢╣µ│ĢµØźńĪ«Ķ«żń╗äĶŻģÕźĮńÜäDNAńÜäÕŁśÕ£©ÕÅŖÕģČÕćåńĪ«µĆ¦ŃĆéõĖƵŚ”ķ¬īĶ»üµŁŻńĪ«’╝īÕłåń”╗Õ╣ȵē®Õó×µŁŻńĪ«ńÜäÕģŗķÜåõ╗źńö©õ║ÄÕÉÄń╗ŁÕ«×ķ¬īŃĆé
Gibsonń╗äĶŻģńÜäµĢģķÜ£µÄÆķÖżõĖÄÕĖĖĶ¦üķŚ«ķóś
õ╗źõĖŗµś»µłæõ╗¼ńĀöÕÅæõĖōÕ«ČÕłåõ║½ńÜäõ╗¢õ╗¼õ╗ÄńĀöń®Čõ║║ÕæśķéŻķćīÕÉ¼Õł░ńÜäõĖĆõ║øµ£ĆÕĖĖĶ¦üńÜäGibsonÕģŗķÜåķŚ«ķóśńÜäĶ¦ŻńŁöŃĆé
1. Õ”éõĮĢÕŖĀÕ┐½ń╗äĶŻģĶ┐ćń©ŗ’╝¤
ńĀöń®Čõ║║ÕæśÕÅ»õ╗źķĆÜĶ┐ćõĮ┐ńö©µ£¬ń╗Åń║»Õī¢ńÜäPCRõ║¦ńē®ŃĆüń╝®ń¤ŁÕÅŹÕ║öµŚČķŚ┤µł¢õĮ┐ńö©Õ┐½ķƤĶĮ¼Õī¢µ¢╣µĪłµØźÕŖĀÕ┐½ń╗äĶŻģĶ┐ćń©ŗŃĆé
õĮ┐ńö©µ£¬ń╗Åń║»Õī¢ńÜäPCRõ║¦ńē®
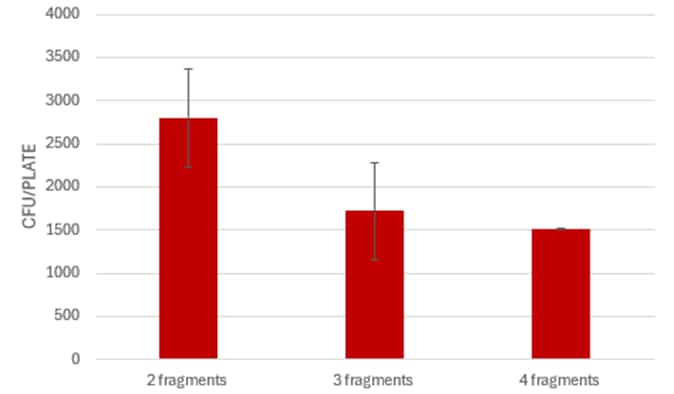
õĖ║õ║åÕŖĀÕ┐½ń╗äĶŻģĶ┐ćń©ŗ’╝īÕÅ»õ╗źĶĆāĶÖæńø┤µÄźõĮ┐ńö©PCRõ║¦ńē®’╝łµŚĀķ£Ćń║»Õī¢’╝ēĶ┐øĶĪīGibsonń╗äĶŻģŃĆéÕŬķ£ĆµöČķøåµ»Åń¦Źńē浫Ąµ£ĆÕżÜ4 ┬ĄL’╝īńäČÕÉÄń╗¦ń╗ŁĶ┐øĶĪīń╗äĶŻģŃĆéĶ┐Öń¦Źń«ĆÕī¢ńÜäµ¢╣µ│ĢÕÅ»õ╗źĶŖéń£üµŚČķŚ┤’╝īÕÉīµŚČõ╗ŹĶāĮĶÄĘÕŠŚµ£ēµĢłńÜäń╗ōµ×£ŃĆé
ń╝®ń¤ŁÕÅŹÕ║öµŚČķŚ┤
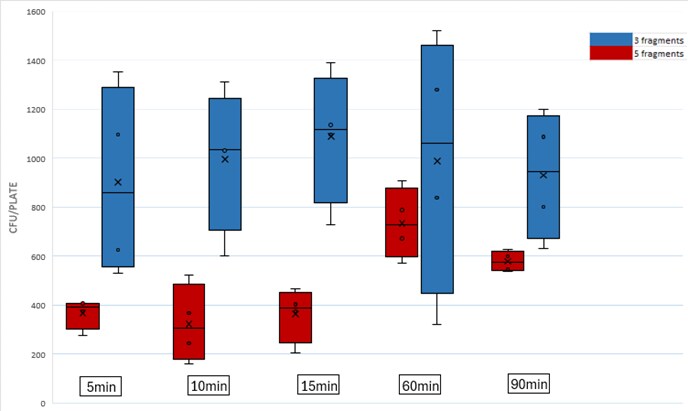
õĖ║õ║åĶŖéń£üµŚČķŚ┤’╝īµé©ÕÅ»õ╗źń╝®ń¤Łń╗äĶŻģµŚČķŚ┤ŃĆéĶ»źÕŹÅĶ««µŚČķŚ┤ķÆłÕ»╣õĖŹÕÉīńÜäń╗äĶŻģĶ┐øĶĪīõ║åõ╝śÕī¢’╝īńĪ«õ┐Øõ║¦ķćÅõĖŹõ╝ÜÕÅŚÕł░µśŠĶæŚÕĮ▒ÕōŹŃĆéĶ┐Öń¦Źń«ĆÕī¢ńÜäµ¢╣µ│ĢõĖŹõ╗ģĶŖéń£üµŚČķŚ┤’╝īĶ┐śĶāĮõ┐صīüµ£ēµĢłńÜäń╗ōµ×£’╝īõĮ┐µé©ńÜäÕĘźõĮ£µĄüń©ŗµø┤ÕŖĀķ½śµĢłŃĆé
õĮ┐ńö©Õ┐½ķƤĶĮ¼Õī¢µ¢╣µĪł

Õ»╣õ║ÄÕĖīµ£øÕŖĀÕ┐½ĶĮ¼Õī¢Ķ┐ćń©ŗńÜäńö©µłĘ’╝īÕÅ»õ╗źĶĆāĶÖæõĮ┐ńö©Õ┐½ķƤĶĮ¼Õī¢µ¢╣µĪłŃĆéĶ┐Öń¦Źµ¢╣µ│ĢÕīģµŗ¼ń╝®ń¤ŁÕŁĄĶé▓µŚČķŚ┤’╝īÕ╣ČõĮ┐ńö©õĖōõĖ║Õ┐½ķƤĶĮ¼Õī¢ĶĆīõ╝śÕī¢ńÜäĶ»ĢÕēéŃĆéÕŬķ£ĆÕ░åµä¤ÕÅŚµĆüń╗åĶā×õĖÄDNAµĘĘÕÉł’╝īńäČÕÉÄńø┤µÄźµČéÕĖāÕł░ķĆēµŗ®µĆ¦LBńÉ╝ĶäéÕ╣│µØ┐õĖŖ’╝īµŚĀķ£ĆńāŁµ┐Ƶł¢µüóÕżŹµŁźķ¬żŃĆé
Ķ»źµ¢╣µ│ĢÕ£©õĮ┐ńö©µ░©ĶŗäķØÆķ£ēń┤ĀķĆēµŗ®Õ╣│µØ┐Ķ┐øĶĪīĶĮ¼Õī¢µŚČÕ░żÕģȵ£ēµĢłŃĆéÕ┐½ķƤµ¢╣µĪłÕÅ»µśŠĶæŚÕćÅÕ░æµēĆķ£ĆµŚČķŚ┤’╝īÕÉīµŚČĶĮ¼Õī¢µĢłńÄćõ╗ģµ£ēÕŠ«Õ░ÅÕÅśÕī¢ŃĆé
2. Golden Gateń╗äĶŻģõĖÄGibsonń╗äĶŻģ’╝ܵ£ēõ╗Ćõ╣łÕī║Õł½’╝īµłæÕ║öĶ»źńö©Õō¬õĖĆõĖ¬Ķ┐øĶĪīÕģŗķÜå’╝¤
Õ£©DNAÕģŗķÜåµ¢╣ķØó’╝īķĆēµŗ®ÕÉłķĆéńÜäń╗äĶŻģµ¢╣µ│Ģõ╝ܵśŠĶæŚÕĮ▒ÕōŹÕ«×ķ¬īńÜ䵳ÉÕŖ¤ŃĆéGolden Gateń╗äĶŻģÕÆīGibsonń╗äĶŻģµś»õĖżń¦ŹÕĖĖńö©µŖƵ£»’╝īÕÉäĶć¬Õģʵ£ēńŗ¼ńē╣õ╝śÕŖ┐ŃĆé
Golden Gateń╗äĶŻģÕł®ńö©IISÕ×ŗķÖÉÕłČµĆ¦ÕåģÕłćķģȵ×äÕ╗║µŚĀń╝ØDNAńē浫Ą’╝īÕøĀµŁżÕ£©ķćŹÕżŹµĆ¦ÕģŗķÜåõ╗╗ÕŖĪõĖŁµĢłńÄćÕŠłķ½śŃĆéĶĆīGibsonń╗äĶŻģÕłÖķĆÜĶ┐ćµĘĘÕÉłÕżÜń¦ŹķģČ’╝īÕ£©ÕŹĢõĖƵüƵĖ®ÕÅŹÕ║öõĖŁĶ┐×µÄźÕżÜõĖ¬DNAńē浫Ą’╝īķĆéńö©õ║Äń╗äĶŻģµø┤Õż¦ŃĆüµø┤ÕżŹµØéńÜäń╗ōµ×äŃĆé
Õ”éµ×£õĮĀńÜäķĪ╣ńø«ķ£ĆĶ”üķ½śń▓ŠÕ║”ńÜ䵩ĪÕØŚÕī¢ÕģŗķÜå’╝īGolden Gate µ¢╣µ│ĢÕÅ»ĶāĮµś»µø┤õ╝śńÜäķĆēµŗ®ŃĆéńäČĶĆī’╝īÕ”éµ×£ķ£ĆĶ”üÕÉīµŚČń╗äĶŻģÕż¦ńē浫ĄDNAµł¢ÕżÜõĖ¬µÅÆÕģźńē浫Ą’╝īGibson Assembly ÕÅ»ĶāĮµø┤õĖ║ÕÉłķĆéŃĆéõ║åĶ¦ŻÕģŗķÜåķĪ╣ńø«ńÜäÕģĘõĮōķ£Ćµ▒éÕ░åµ£ēÕŖ®õ║ÄõĮĀÕå│Õ«ÜõĮ┐ńö©Õō¬ń¦Źµ¢╣µ│ĢŃĆé
3. Õ”éõĮĢĶ«ŠĶ«ĪGibsonń╗äĶŻģńÜäÕ╝Ģńē®’╝¤
õĖ║Gibsonń╗äĶŻģĶ«ŠĶ«ĪÕ╝Ģńē®µŚČ’╝īķ£ĆĶ”üÕłøÕ╗║Õ£©Õģȵ£½ń½»Õģʵ£ēķćŹÕÅĀÕ║ÅÕłŚńÜäÕ╝Ģńē®’╝īõ╗źõŠ┐õĖÄÕŠģĶ┐׵ğńÜäDNAńē浫Ąµ£½ń½»Õī╣ķģŹŃĆéõ╗źõĖŗµś»Õģ│ķö«µŁźķ¬ż’╝Ü
- ńĪ«Õ«ÜķćŹÕÅĀÕī║Õ¤¤’╝ÜńĪ«Õ«Üµ»ÅõĖ¬ńē浫ĄĶ┐׵ğµēĆķ£ĆńÜä20-40õĖ¬ńó▒Õ¤║ńÜäķćŹÕÅĀÕ║ÅÕłŚŃĆé
- Ķ«ŠĶ«ĪÕ╝Ģńē®Õ║ÅÕłŚ’╝ÜńĪ«õ┐ص»ÅµØĪÕ╝Ģńē®ńÜä5ŌĆ▓ń½»ÕīģÕɽķćŹÕÅĀÕ║ÅÕłŚ’╝īĶĆī3ŌĆ▓ń½»ÕłÖõĖ║õĖÄńø«µĀćDNAõ║ÆĶĪźńÜäÕī║Õ¤¤ŃĆé
- µŻĆµ¤źńåöĶ¦ŻµĖ®Õ║”’╝ÜńĪ«Ķ«żµēĆĶ«ŠĶ«ĪÕ╝Ģńē®ńÜäńåöĶ¦ŻµĖ®Õ║”’╝łTm’╝ēńøĖÕ«╣’╝īńÉåµā│µāģÕåĄõĖŗÕĮ╝µŁżõ╣ŗķŚ┤ńÜäÕĘ«Õ╝éÕ║öÕ£©2-3┬░Cõ╗źÕåģŃĆéķĆēµŗ®ńåöĶ¦ŻµĖ®Õ║”’╝łTm’╝ēķ½śõ║Ä50┬░CńÜäÕÉīµ║ÉķćŹÕÅĀÕī║Õ¤¤ÕÅ»õ╗źµÅÉķ½śń╗äĶŻģµĢłńÄćŃĆé
- ķü┐ÕģŹõ║īń║¦ń╗ōµ×ä’╝ÜõĮ┐ńö©ĶĮ»õ╗ČÕĘźÕģĘńĪ«õ┐صé©ńÜäÕ╝Ģńē®õĖŹõ╝ÜÕĮóµłÉÕÅæÕż╣ń╗ōµ×䵳¢õ║īĶüÜõĮōŃĆéķüĄÕŠ¬Ķ┐Öõ║øµŁźķ¬żÕ░åÕĖ«ÕŖ®µé©Ķ«ŠĶ«ĪÕć║ķ½śµĢłńÜäÕ╝Ģńē®’╝īõ╗źńĪ«õ┐ØGibsonń╗äĶŻģÕÅŹÕ║öńÜ䵳ÉÕŖ¤ŃĆé
4. DNAńē浫ĄĶ┐øĶĪīGibsonń╗äĶŻģµŚČÕÉłķĆéńÜäķćŹÕÅĀķĢ┐Õ║”µś»ÕżÜÕ░æ’╝¤
Gibsonń╗äĶŻģńÜäÕÉłķĆéķćŹÕÅĀķĢ┐Õ║”ķĆÜÕĖĖÕ£©20Õł░40õĖ¬ńó▒Õ¤║Õ»╣õ╣ŗķŚ┤ŃĆéĶ┐ÖõĖĆķĢ┐Õ║”ĶČ│õ╗źńĪ«õ┐Øńē浫Ąõ╣ŗķŚ┤ĶāĮÕż¤ńē╣Õ╝éµĆ¦õĖöń©│Õ«ÜÕ£░ķĆĆńü½ń╗ōÕÉłŃĆé
ń¤Łõ║Ä20 bpńÜäķćŹÕÅĀÕÅ»ĶāĮµŚĀµ│ĢµÅÉõŠøĶČ│Õż¤ńÜäńē╣Õ╝éµĆ¦ÕÆīń©│Õ«ÜµĆ¦’╝īõ╗ÄĶĆīÕ»╝Ķć┤ń╗äĶŻģµĢłńÄćõĮÄõĖŗ’╝øĶĆīķĢ┐õ║Ä40 bpńÜäķćŹÕÅĀÕÅ»ĶāĮõĖŹõ╝ܵśŠĶæŚµÅÉķ½śµĢłńÄć’╝īÕÅŹĶĆīõ╝ÜõĮ┐Õ╝Ģńē®Ķ«ŠĶ«Īµø┤ÕŖĀÕżŹµØéŃĆéÕøĀµŁż’╝īÕ£©Gibsonń╗äĶŻģĶ┐ćń©ŗõĖŁ’╝īõ┐صīüÕ£©µŁżĶīāÕø┤ÕåģĶ«ŠĶ«ĪķćŹÕÅĀÕ║ÅÕłŚÕ»╣õ║ÄÕ«×ķ¬īńÜ䵳ÉÕŖ¤Ķć│Õģ│ķćŹĶ”üŃĆé
GibsonńŁēµĖ®ń╗äĶŻģ’╝ÜõĖĆń¦ŹõŠ┐µŹĘÕ┐½ķƤńÜäµø┐õ╗ŻÕģŗķÜåµ¢╣µ│Ģ
Gibsonń╗äĶŻģµś»õĖĆń¦ŹÕżÜÕŖ¤ĶāĮõĖöķ½śµĢłńÜäDNAń╗äĶŻģµ¢╣µ│Ģ’╝īķĆÜĶ┐ćń▓ŠÕ┐āĶ¦äÕłÆÕÆīµ│©ķćŹń╗åĶŖé’╝īµé©ÕÅ»õ╗źµÄīµÅĪĶ»źµŖƵ£»ŃĆéķĆÜĶ┐ćķüĄÕŠ¬õĖŖĶ┐░Õģ│ķö«µŖĆÕʦ’╝īµé©ÕÅ»õ╗źõ╝śÕī¢Õ«×ķ¬īµ¢╣µĪł’╝īÕ£©ÕģŗķÜåÕ«×ķ¬īõĖŁĶÄĘÕŠŚÕÅ»ķØĀõĖöķ½śĶ┤©ķćÅńÜäń╗ōµ×£ŃĆé
ńøĖÕģ│ńÜäGibsonń╗äĶŻģĶĄäµ║ÉõĖĵŖƵ£»
- õ║¦Õōü: GeneArt Gibson ń╗äĶŻģķ½śõ┐Øń£¤ÕģŗķÜåĶ»ĢÕēéńøÆ
- Õ«×ķ¬īµĄüń©ŗ: õĮ┐ńö© GeneArt Gibson Assembly HiFi ÕģŗķÜåĶ»ĢÕēéńøÆĶ┐øĶĪīÕ«Üńé╣Ķ»▒ÕÅś
- ńÖĮńÜ«õ╣”: Õł®ńö©µŚĀń╗åĶā× Gibson ń╗äĶŻģÕÆīµ╗ÜńÄ»µē®Õó×ÕĘźõĮ£µĄüń©ŗÕ«×ńÄ░õ╗Ä DNA µ×äÕ╗║Õł░ĶøŗńÖĮĶ┤©ĶĪ©ĶŠŠõ╗ģķ£ĆõĖĆÕż®
- ÕŁ”õ╣ĀķĪĄķØó: DNA ÕģŗķÜåµŖĆÕʦŌĆöŌĆöõĮ┐ńö© DNA ńē浫ĄķĆÜĶ┐ć Gibson ń╗äĶŻģµ×äÕ╗║ÕģŗķÜå
- ńÖĮńÜ«õ╣”: ń╗ōÕÉłÕÉīµ║ÉķćŹń╗äõĖĵĀĖĶŗĘķģĖµŗ╝µÄźµŖƵ£»µ×äÕ╗║Õż¦Õ×ŗĶ┤©ń▓Æ
##
┬® 2025 Thermo Fisher Scientific Inc. All rights reserved. All trademarks are the property of Thermo Fisher Scientific and its subsidiaries unless otherwise specified. SnapGene is a trademark of GSL Biotech LLC. Gibson Assembly is a trademark of Telesis Bio Inc.
For Research Use Only. Not for use in diagnostic procedures.




ÕÅæĶĪ©Õø×ÕżŹ