新たなPCR検出系を構築する場合、何よりもプライマーの配列が重要ということは多くの方が認識しているのではないでしょうか。高性能なプライマーができれば、PCR条件があまり最適化されていなくても高品質な結果を得ることは難しくありません。もしPCRがうまくいかない場合は、プライマーの配列を変更することで劇的にうまくいくこともあります。
しかし、プライマーの配列を変えることができない場合はどうでしょうか。その場合、PCR反応に関わるさまざまな要素を検討する必要があります。例えば、使用するDNAポリメラーゼ、鋳型DNAの投入量、伸長反応の時間などなど。細かく挙げればきりがないですが、中でも影響が大きいのはアニーリング温度ではないでしょうか。アニーリング温度はプライマー配列からNearest Neighbor法などにより算出されるTm値を目安に設定することが一般的です。しかしこのTm値はあくまでも計算上得られる値なので、実際のPCR反応ではアニーリング温度の最適化が必要になることがあります。
本記事では、アニーリング温度を大きく振ってみてPCR増幅産物がどのように変化するか、検証してみました。この結果を見れば、PCR反応がうまくいかないときにアニーリング温度をどう最適化すればよいかが分かるようになります。
▼こんな方におすすめです!
- PCR条件の最適化について知りたい方
▼もくじ
材料と方法
以下のレシピに従い、アニーリング温度を24~72 ℃まで3 ℃刻みで変化させてPCR反応後、アガロースゲル電気泳動でバンドパターンを確認しました。
1.PCR反応液の組成
| Component | 1反応あたり(µL) |
|---|---|
| Applied Biosystems™ AmpliTaq Gold™ 360 Master Mix (製品番号 4398876) | 25 |
| Forward & Reverse Primer Mix 10 µM(終濃度200 nM) ※1 | 1 |
| Human genomic DNA(1 ng/µL) | 1 |
| Nuclease Free Water | 23 |
| Total | 50 |
※1 プライマーはCD44、 EGFR、 HPRT1、 AAVS1の4種類のプライマーセットを使用。
2.PCR条件
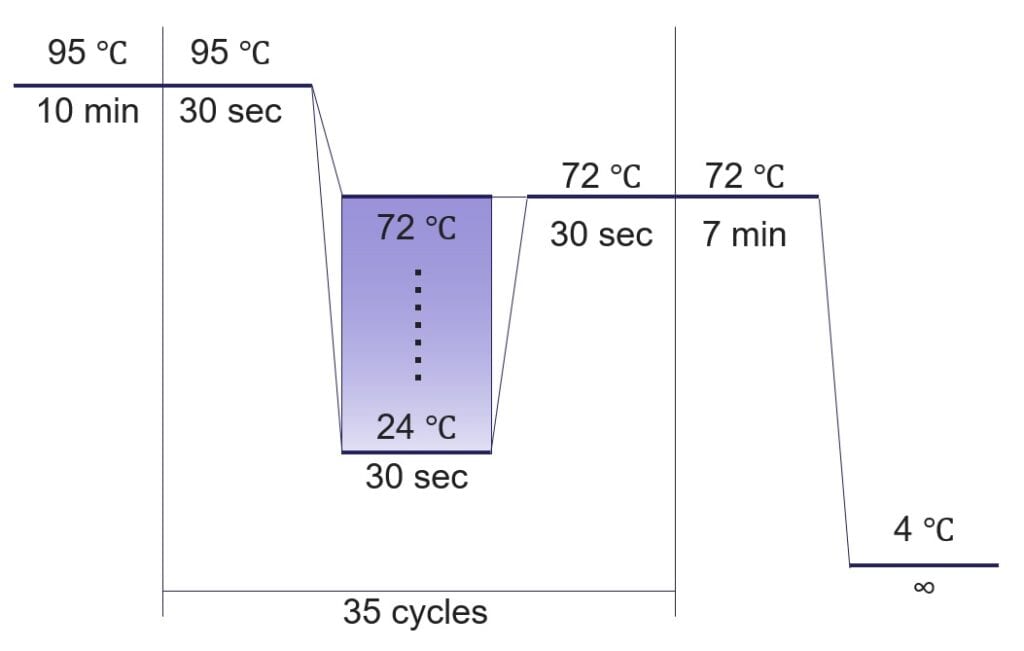
アニーリング温度の変化(24~72 ℃。3 ℃刻みで設定)は Applied Biosystems™ VeritiPro™ サーマルサイクラーのVeriFlex™機能により行いました。全てのアニーリング温度の条件を試験するため、PCR反応は3回に分けて実施しました。
3.使用したプライマーの配列とTm値
| Gene Name | Forward Sequence | Forward Tm(℃)※2 |
Reverse Sequence | Reverse Tm(℃)※2 |
ΔTm(℃) |
|---|---|---|---|---|---|
| EGFR | ATGGGTGAGTCTCTGTGTGG | 58.6 | CCCAGGCCTTTCTCCACTTA | 59.2 | 0.6 |
| CD44 | GTGCTGGGATTGTAGGCATG | 57.7 | ACGTGGGGTTGACTCCTTAG | 58.9 | 1.2 |
| HPRT1 | GGCGTCGTGATTAGTGATGAT | 59.1 | GCCCAAAGGGAACTGATAGTC | 60.5 | 1.4 |
| AAVS1 | GAATATGTCCCAGATAGCAC | 51.6 | GTTCTCAGTGGCCACCCTGC | 63.2 | 11.6 |
※2 Tm値はTm Calculatorで算出。
結果
それでは泳動結果を見ながら考察していきましょう。

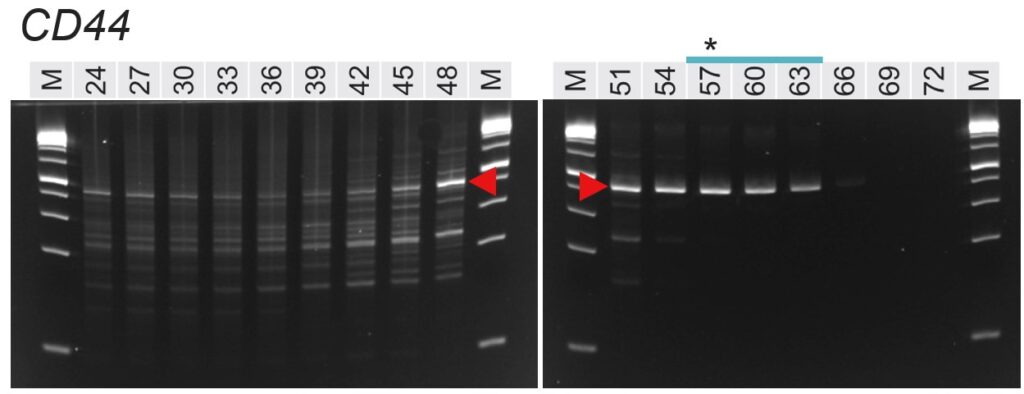
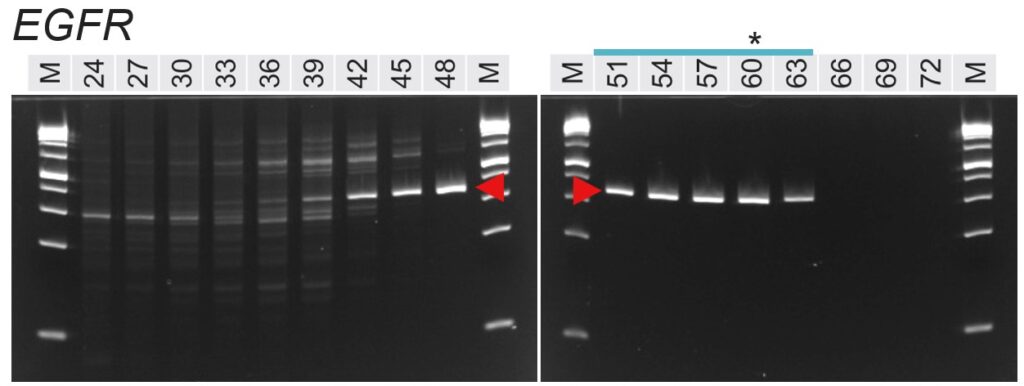
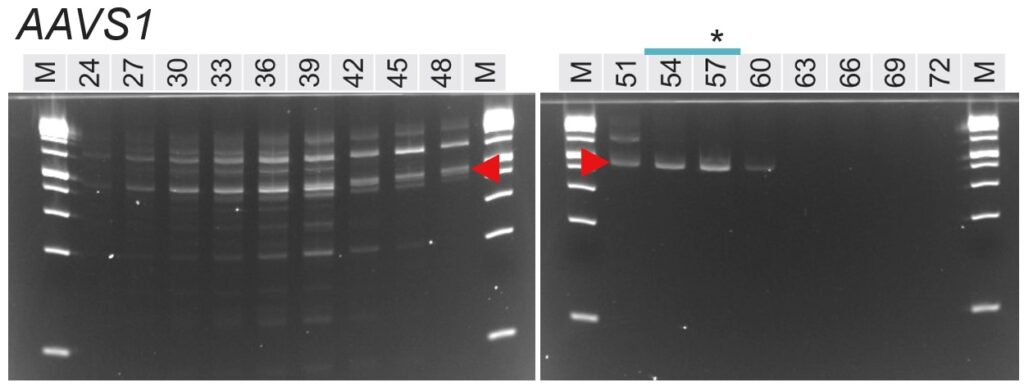
図. 各PCR条件のアガロースゲル電気泳動像
赤矢頭:特異的なバンド
*:計算上のTm値の近似値(Tm Calculatorで算出したForwardとReverseのプライマーTm値の平均)
泳動像上部の数値:アニーリング温度(℃)
泳動像上部の青線:明瞭なシングルバンドとして検出されたレーン
1.アニーリング温度と特異的バンドの関係
まず、各泳動像において想定される特異的なバンドは赤矢頭で示していします。アニーリング温度が高い場合は特異的なバンドも含め、何も検出されていません。PCRで増幅するためにはプライマーが鋳型DNAに結合(アニール)する必要がありますが、温度が高すぎるとプライマーが結合できず、結果的に増幅しないためです。
一方、アニーリング温度が低い場合は、プライマーセット4種の全てで非特異的なバンドが顕著に増加しました。これは、温度が低いことでプライマーが特異的な配列以外にも結合し、本来増えてほしくない増幅が起こったためと考えられます。
泳動結果を詳しく見ると、どのプライマーセットでも低温度帯(非特異的に増幅する)と高温度帯(バンドが検出されない)の間の適切な温度帯において、本来増えるべきバンドのみが検出されていることが分かります。
このことから、PCR条件を最適化するためには以下のような考え方ができます。
- 非特異的なバンドがある場合→アニーリング温度を上げる
- 目的のバンドが検出されない場合→アニーリング温度を下げる
2.極端に低いアニーリング温度の影響
興味深いことに、アニーリング温度が極端に低い(24 ℃など)場合はバンドが減ったり、何も検出されなくなるプライマーセットもあったりしました(HPRT1やAAVS1)。これは本記事の本質的なテーマとは離れますが、温度が低いとDNAの2本鎖形成(つまりアニーリング)するために必要な時間が長くなるためと考えられます。DNAの2本鎖形成を含む一般的な化学反応では、反応が進むためにはある程度の温度(熱エネルギー)が必要であり、温度が低い場合には反応時間を長くする必要があります。今回のアニーリングステップの時間は30秒と短かったため、非特異的にでもプライマーがアニールする時間が足りず、泳動像でDNAが検出されなかった可能性があります。
3.Tm値を基準にしたアニーリング温度設定
さらに今回の結果を、他の観点からも考察もしてみましょう。一般的に初めて使用するプライマーセットでは、そのTm値(またはそこから少し低い温度)を目安にアニーリング温度を設定します。Tm値はその配列のDNAのうち50%が2本鎖(残りの50%が1本鎖)となる温度です。これは2本鎖と1本鎖の境界の温度ということもできます。アニーリング温度をTm値の温度付近にすることで、プライマーが適切に鋳型DNAに結合しつつ、余計な配列には結合しにくくなることが期待できます。その結果、特異的な増幅が得られるというわけです。
各泳動像の上にある星印(*)は、プライマーのTm値の平均を示しています(ForwardとReverseの平均に最も近い温度)。星印と実際のバンドパターンと見比べてみると、おおむね星印のあるアニーリング温度で明瞭なシングルバンドが見られ、このアプローチが成功していることが分かります。ただし、HPRT1では星印のある60 ℃ではまったくバンドが見えませんでした。このようにTm値を目安にアニーリング温度を設定することが有効ではありますが、あくまで計算上の数値ですので、うまくいかない例もあることに注意が必要です。
そのため、初めて使用するプライマーセットの場合、計算上のTm値を中心に、アニーリング温度を上下に数℃ずつ変えた予備実験をしておくと、最初から適切なアニーリング温度が設定できるのでおすすめです。
4.各プライマーセットの特異的検出範囲
最後に、泳動像の上にある青線は、明瞭なシングルバンドとして検出できているレーンを示しています。EGFRでは51~63 ℃に渡って広い温度帯で特異的な検出ができている一方、AAVS1では54~57 ℃の狭い範囲となっています(60 ℃もシングルバンドですが薄いため除外しました)。
プライマーはPCRの結果に大きく影響を及ぼします。今回のEGFRように、PCRの温度条件が最適な条件から多少離れていても問題なく特異的な検出ができるプライマーもあれば、AAVS1のように少し最適条件からずれてしまうとバンドが見えなかったり非特異的な増幅が現れたりするものもあります。プライマーの配列によってPCR条件の最適化がどれくらい大変になるか大きく変わることもあるため、PCR条件の最適化に行き詰まったらプライマーの配列を変更することで驚くほどすんなりとうまくいくこともあります。
実は今回のAAVS1については、このようになった原因が推測できます。AAVS1のプライマーのTm値は、Forwardが51.6 ℃、reverseが63.2 ℃と、11.6 ℃もの差があります。プライマーセットをデザインする際には、2つのプライマーのTm値をできるだけ近づけてデザインすることが推奨されます。これまで見てきたように、PCR反応中のアニーリング温度が高いとうまく結合しませんし、低いと非特異的な増幅が増えてしまいます。ForwardとReverseでTm値が大きく異なる場合、どちらかに合わせるにしても平均値をとるにしても、うまくアニールしにくくなることは想像に難くありません。目安は±2 ℃、大きくても±5 ℃以内に抑えたいところです。
今回、AAVS1のプライマーセットの結果で最適なアニーリング温度帯の幅が狭いことは、このTm値の乖離が大きく影響しているものと思われます。なお筆者個人の感想として、今回のAAVS1のプライマーセットで特異的な増幅が確認できたことが意外でした(まともに増えないだろうと思っていました)。
まとめ
アニーリング温度の最適化はPCRに慣れている方にとっては当たり前かも知れませんが、下は24 ℃(常温)、上は72 ℃(伸長反応の温度)まで幅広く試した方はほとんどいらっしゃらないのではないでしょうか。アニーリング温度がPCRの結果に与える影響を見ることで、PCRについての皆さまの知見を深める一助となりましたら幸いです。
当社ではPCRをはじめ、細胞培養、タンパク質実験、ゲノム編集など、実習を行いつつ学べるハンズオントレーニングを多数開催しています。その中で今回のような実験結果もご紹介していますので、これから新しい実験を始められる方、より理解を深めたい方はぜひご参加ください!
- ハンズオントレーニングの一覧ページはこちら
これからPCR実験を始めたい方、PCRについて学びたい方におすすめです。
分子生物学教室PDF版 無料ダウンロードはこちら
研究用にのみ使用できます。診断用には使用いただけません。
AmpliTaq Gold is a trademark of Roche Molecular Systems, Inc., used under permission and license.



